
Entwicklung von Prototypen medizinischer Geräte: Von der Softwaregestaltung bis zur regulatorischen Prüfung
Ich werde nicht lügen: Viele der Projekte, die wir bei Scythe Studio durchführen, sind mit der Medizingerätebranche verbunden. Wir haben […]
Join us at Qt C++ Warsaw Meetup - 21.08.2025
Sign up for free!
Die Entwicklung von medizinischer Software unterliegt strengen Regeln, die eingehalten werden müssen. Aufgrund der Art und Weise, wie solche Software funktioniert – sie kann beispielsweise direkt mit Patienten in Kontakt treten oder Patientendaten verarbeiten – muss sie Vorschriften folgen, um Sicherheit, hohe Qualität oder Leistung zu gewährleisten.
In diesem Beitrag werde ich die wesentlichen Merkmale des ISO 13485 Standards umreißen. Wir werden auch seine Rolle in der Entwicklung von medizinischer Software und die Vorteile für Hersteller in der Medizintechnikbranche besprechen. Dieser Artikel ist nicht als Anleitung zur Einrichtung eines Qualitätsmanagementsystems (QMS) gedacht. Vielmehr geht es darum, Ihnen als Gründer oder Geschäftsführer eines Medizinprodukteunternehmens in Kürze zu erklären, was ISO 13485 ist.
Ich schreibe dies aus der Perspektive eines B2B-Softwareunternehmens, das Software- und Hardwarelösungen für Medizintechnikunternehmen entwickelt. Wir haben erfolgreich ein Qualitätsmanagementsystem gemäß dem ISO 13485-Rahmenwerk eingeführt, daher wissen wir, dass wir neben den Kundenanforderungen auch regulatorische Anforderungen erfüllen müssen.
ISO 13485 beeinflusst unsere Design- und Entwicklungsdienstleistungen. Entdecken Sie, wie Scythe Studio diese Herausforderung bei der Bereitstellung von Softwareentwicklungsdiensten für Medizinprodukte angeht.
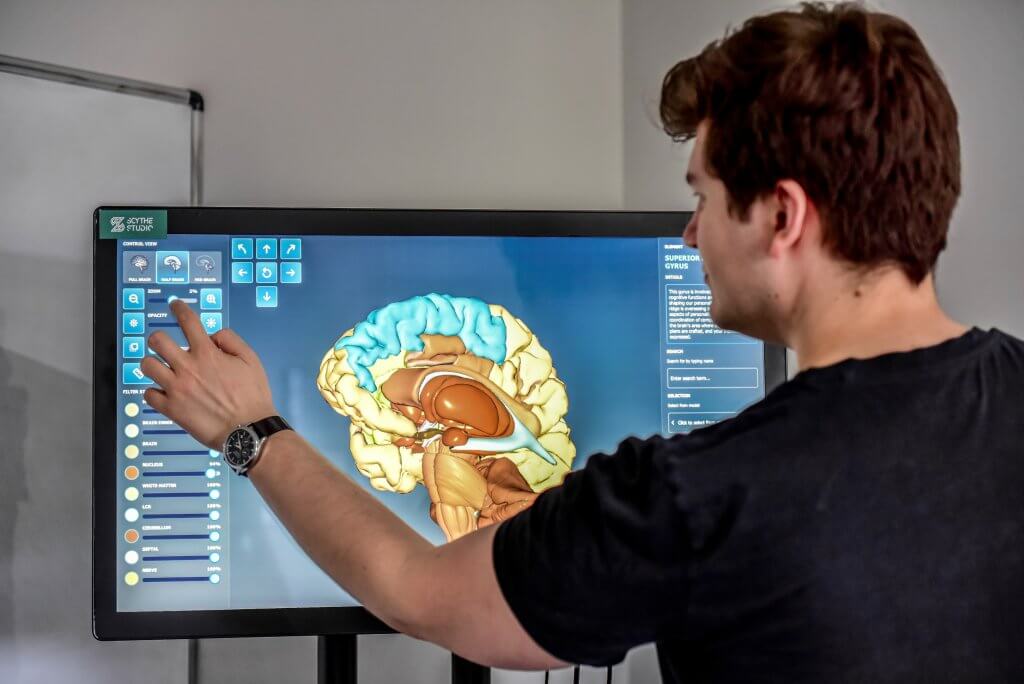 Plattformübergreifende Anwendung zur Vorschau von Teilen des Gehirns
Plattformübergreifende Anwendung zur Vorschau von Teilen des Gehirns
Der ISO 13485:2016 Standard ist eine internationale Norm, die für Qualitätsmanagementsysteme (QMS) in der Herstellung und dem Design von Medizinprodukten entwickelt wurde. Sie definiert Prinzipien, die den Herstellern von Medizinprodukten helfen, die Anforderungen der Endnutzer sowie regulatorische Standards für Sicherheit und Effizienz zu erfüllen.
Die Einrichtung eines konformen Qualitätsmanagementsystems ist ein Schritt, der früh in der Entwicklungsphase erfolgen muss, da Medizinprodukteunternehmen es benötigen, um regulatorische Anforderungen zu erfüllen und ihre Projekte erfolgreich einzureichen. Sie sollten ein QMS sowohl für Software in Medizinprodukte (SiMD) als auch für Software als Medizinprodukt (SaMD) Projekte einführen. Wir haben die Unterschiede zwischen diesen beiden in einem unserer früheren Artikel beschrieben – SiMD vs SaMD.
ISO 13485 ist ein Standard, der von der Internationalen Organisation für Normung (ISO) entwickelt wurde. Er gilt nicht nur, wenn ein Medizinprodukt auf den Markt gebracht wird, sondern auch während des gesamten Lebenszyklus eines Medizinprodukts. Innerhalb dieses Standards gibt es Anforderungen für Risikomanagement, Qualitätsmanagement und – meiner Meinung nach am wichtigsten – kontinuierliche Validierungs- und Verbesserungsprozesse.
Der Standard selbst folgt vielen Vorschriften in verschiedenen Teilen der Welt. Zum Beispiel ist diese Norm mit dem CE-Zeichen in Europa kompatibel, das anzeigt, dass ein Produkt vom Hersteller getestet wurde und die EU-Anforderungen erfüllt. Ein weiteres Beispiel ist die amerikanische FDA (Food and Drug Administration), die eine positive Meinung zur Sicherheit und Wirksamkeit eines Medizinprodukts abgeben muss.
 ISO 13485
ISO 13485
Sie müssen wissen, dass ISO 13485 zwar ein weltweit anerkannter Standard ist, aber auch andere medizinische Organisationen, die an der regulatorischen Compliance beteiligt sind, ihre eigenen Anforderungen an das Qualitätsmanagement haben. Zum Beispiel hat die US FDA (Food and Drug Administration) 21 CFR 820 eingeführt.
Obwohl 21 CFR 820 ISO 13485 nicht direkt integriert, sind sie stark miteinander abgestimmt. Viele Medizinprodukteunternehmen beginnen mit einem Qualitätsmanagementsystem als Basis und passen dann einige Aspekte davon an die spezifischen US-amerikanischen regulatorischen Anforderungen an.
21 CFR 820 wurde eingeführt, um es Unternehmen zu erleichtern, neue Geräte auf den Markt zu bringen. Das ist nur mein schelmischer Kommentar, aber es ist schade, dass die EU-Institutionen nicht zu ähnlichen Schlussfolgerungen kommen.
 FDA 21 CFR 820
FDA 21 CFR 820
ISO 13485 basiert auf einem Qualitätsmanagementsystem (QMS), das Unternehmen hilft, zu organisieren und zu standardisieren, wie sie Medizinprodukte entwickeln und liefern. Für medizinische Software bedeutet ein QMS, dass Prozesse vorhanden sind, um Risiken zu managen, wichtige Aktionen zu dokumentieren und die Qualität in jedem Schritt zu überprüfen. Es geht nicht nur darum, Audits zu bestehen; es geht darum, starke, wiederholbare Prozesse aufzubauen, die zu sichereren Produkten führen.
Medizinprodukteunternehmen müssen ihre Qualitätsziele und die Bereiche, in denen das Qualitätsmanagementsystem anwendbar ist, definieren. Diese müssen Aktivitäten betreffen, die direkt die Entwicklung, Qualität, Sicherheit und regulatorische Compliance der Medizinprodukte betreffen. Denken Sie daran, dass das QMS nicht alle Operationen in Ihrem Unternehmen regeln muss.
Nur um ein Beispiel zu geben: Für Unternehmen wie Scythe Studio sollten Produktdesign und -entwicklungsaktivitäten wie das Programmieren den relevanten regulatorischen Anforderungen unterliegen, aber Aktivitäten wie Personalwesen, allgemeine Verwaltung oder Marketing sind davon nicht betroffen.
Einer der Hauptpunkte dieser Zertifizierung ist, dass das Management eine Schlüsselrolle in der Qualität spielen sollte. Führungskräfte müssen Qualitätsziele festlegen, Ressourcen zuweisen und eine reibungslose Kommunikation im Team sicherstellen. Dies bedeutet oft, dass Führungskräfte die Qualität, Compliance und Risikomanagement in der medizinischen Software vollständig unterstützen müssen. Wenn das Top-Management sich der Qualität verpflichtet fühlt, bildet es eine solide Grundlage für alle Beteiligten.
Durch die Arbeit in der Medizintechnikindustrie haben wir gelernt, dass gute Beispiele und Qualitätsorientierung vom Top-Management ausgehen sollten.
 Qualitätsmanagementsystem in der medizinischen Industrie
Qualitätsmanagementsystem in der medizinischen Industrie
ISO 13485 hebt hervor, dass die richtigen Ressourcen vorhanden sein müssen, von qualifizierten Mitarbeitern bis hin zu einer unterstützenden Arbeitsumgebung. Medizinsoftware erfordert qualifizierte Entwickler, die auch die regulatorischen Regeln verstehen, daher sind kontinuierliche Schulungen und eine angemessene Infrastruktur unerlässlich. Dieser Fokus auf Ressourcen stellt sicher, dass Unternehmen hohe Standards aufrechterhalten und Teams auf spezifische Anforderungen im medizinischen Bereich vorbereiten.
Mit Ressourcenmanagement meine ich nicht nur Menschen, ihre Kompetenzen und Schulungen, sondern auch Infrastruktur, Umgebung und Ausrüstung. Zum Beispiel bei Scythe Studio sind die Arbeitsbedingungen für Softwareingenieure Teil des Qualitätsmanagements. Es ist wichtig sicherzustellen, dass nichts die ordnungsgemäße Gestaltung und Entwicklung beeinträchtigt oder Cybersecurity-Probleme verursacht.
Produktrealisierung umfasst jede Phase der Entwicklung eines Produkts, vom Konzept bis zum fertigen, marktreifen Produkt. Für medizinische Software bedeutet dies, Software zu erstellen, die wie versprochen funktioniert, und dabei strenge Schritte für Design, Test und Validierung zu befolgen. ISO 13485 oder genauer gesagt ein gutes Qualitätsmanagementsystem sorgt dafür, dass jeder Teil der Produktentwicklung gut dokumentiert wird, sodass das Endprodukt sicher und effektiv für die medizinische Nutzung ist. In diesem Bereich zählt jedes Detail, da die Patientensicherheit auf Zuverlässigkeit und Genauigkeit beruht.
ISO 13485 fördert auch die kontinuierliche Leistungsüberwachung und Verbesserung. Für medizinische Software bedeutet dies, regelmäßig Software-Updates durchzuführen, Fehler zu beheben und Benutzerfeedback zu überwachen. Durch regelmäßige Überprüfungen und Verbesserungen bleiben Unternehmen Problemen einen Schritt voraus und halten ihre Produkte an die sich entwickelnden medizinischen Bedürfnisse angepasst. Kontinuierliche Verbesserung ist nicht nur ein nettes Extra, sondern entscheidend dafür, dass die Software sicher und effektiv bleibt.
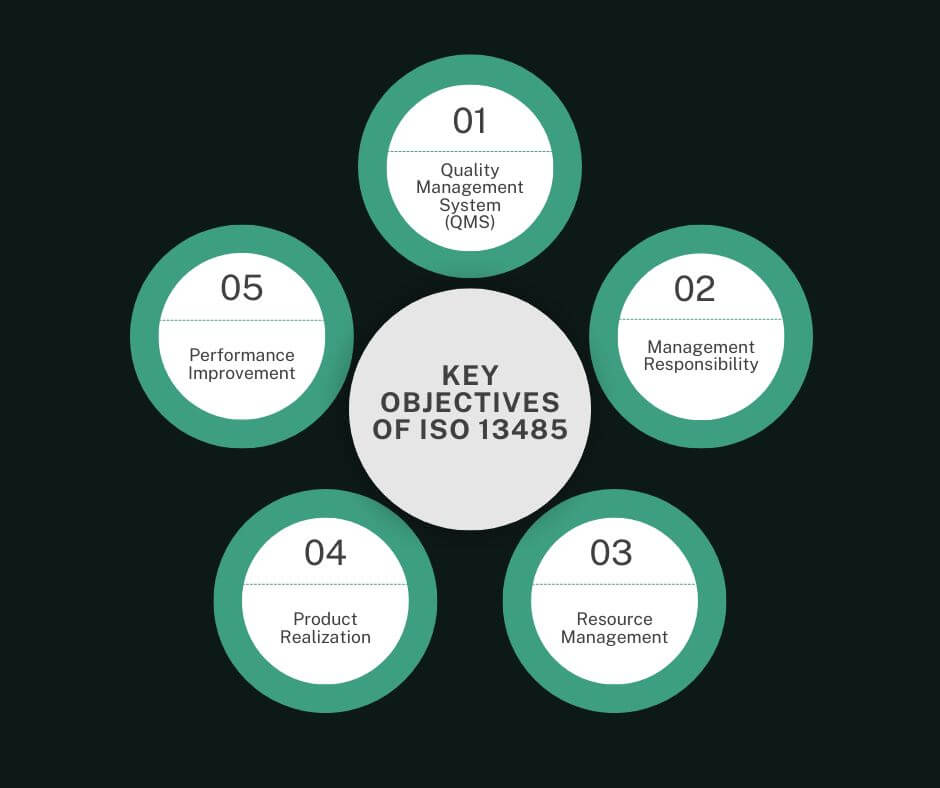 Die wichtigsten Ziele der ISO 13485
Die wichtigsten Ziele der ISO 13485
In der Entwicklung von Medizinsoftware setzt ISO 13485 strenge Anforderungen, die die Softwareingenieure direkt betreffen und ihre Arbeit mit robusten Qualitätsmanagementsystemen (QMS) verbinden. Ingenieure müssen strukturierte Prozesse für Design, Tests und Dokumentation befolgen, um sicherzustellen, dass jede Entwicklungsphase die regulatorischen Sicherheits- und Effektivitätsstandards erfüllt. Dies bedeutet, dass sie sich an Designkontrollen, Risikomanagementpraktiken und Rückverfolgbarkeitsprotokolle halten müssen, die ISO 13485 vorschreibt, was für die regulatorische Zulassung unerlässlich ist. Durch die Ausrichtung ihrer technischen Arbeit auf das QMS spielen Softwareingenieure eine wichtige Rolle beim Schutz der Patientensicherheit und der Compliance in der hochregulierten Medizintechnikindustrie.
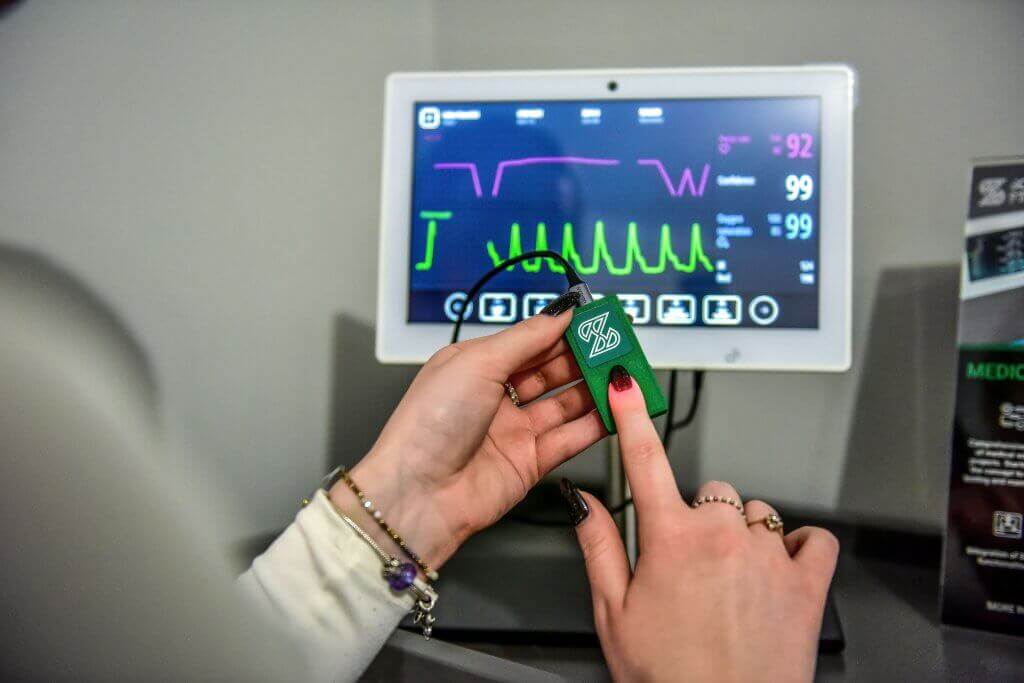 Medizinisches Gerät: Monitor für Vitalparameter des Patienten
Medizinisches Gerät: Monitor für Vitalparameter des Patienten
Sie sollten wissen, dass es noch weitere Qualitätsmanagementstandards gibt. Sowohl ISO 13485 als auch ISO 9001 befassen sich mit diesem Thema. Sie haben jedoch einige entscheidende Unterschiede. ISO 9001 ist ein allgemeinerer Standard, der sich auf Kundenzufriedenheit und kontinuierliche Verbesserung in verschiedenen Sektoren konzentriert. Er ist nicht nur in der Medizintechnikindustrie anwendbar.
Andererseits wurde ISO 13485 speziell für Medizinprodukte entwickelt, mit einem zusätzlichen Schwerpunkt auf regulatorischer Compliance, Risikomanagement und detaillierter Dokumentation. Während ISO 9001 auf allgemeine Verbesserung abzielt, priorisiert ISO 13485 die Patientensicherheit und regulatorische Anforderungen, die in der Medizintechnikindustrie am wichtigsten sind.
 ISO 13485 gegenüber ISO 9001
ISO 13485 gegenüber ISO 9001
Die ISO 13485-Zertifizierung bietet mehrere Vorteile:
Regulatorische Compliance: Die ISO 13485-Zertifizierung hilft Unternehmen, strenge internationale Standards und Vorschriften für Medizinprodukte zu erfüllen. Mit dieser Zertifizierung ist es einfacher, Produkte für verschiedene Regionen zu genehmigen, was Zeit spart und das Risiko kostspieliger Verzögerungen oder Ablehnungen verringert. Sie zeigt, dass die Produkte eines Unternehmens die Sicherheits- und Wirksamkeitsstandards erfüllen, was für den Eintritt in neue Märkte entscheidend ist.
Höhere Produktqualität: Mit der ISO 13485-Zertifizierung folgen Unternehmen strukturierten Qualitätsmanagementprozessen bei der Gestaltung, Entwicklung und Herstellung von Medizinprodukten. Dieser organisierte Ansatz führt zur Entwicklung zuverlässiger, sicherer und effektiver Produkte. Dadurch können Unternehmen das Risiko von Ausfällen oder Sicherheitsproblemen verringern, die den Ruf und das Vertrauen der Kunden schädigen könnten.
Marktzugang: Viele Länder und Gesundheitsmärkte verlangen die ISO 13485-Zertifizierung, um Medizinprodukte verkaufen oder verwenden zu können. Mit dieser Zertifizierung erhalten Unternehmen einen einfacheren Zugang zu internationalen Märkten.
Erhöhte Glaubwürdigkeit: Die ISO 13485-Zertifizierung zeigt das Engagement eines Unternehmens für Qualität und Sicherheit. Sie sendet eine klare Nachricht an Kunden, Patienten, Gesundheitsdienstleister und Aufsichtsbehörden, dass das Unternehmen hohe Standards erfüllt.
Kurz gesagt, die ISO 13485-Zertifizierung ist nicht nur eine regulatorische Anforderung, sondern auch ein Asset, das das Wachstum unterstützt, die Produktqualität stärkt und einen soliden Ruf in der Medizintechnikbranche aufbaut.
 Vorteile der Zertifizierung nach ISO 13485
Vorteile der Zertifizierung nach ISO 13485
Unser Weg zur ISO 13485-Zertifizierung war eine Reise voller Herausforderungen und wertvoller Lektionen. Diese Zertifizierung, die sich auf Qualitätsmanagementsysteme für Medizinprodukte konzentriert, erforderte einen gründlichen Blick auf jeden Teil unseres Betriebs. Wir mussten uns intensiv mit der Erstellung und Pflege detaillierter Dokumentationen befassen, was viel Aufwand und Aufmerksamkeit erfordert hat. Es ging nicht nur darum, Dinge aufzuschreiben, sondern sicherzustellen, dass alle unsere Aufzeichnungen den spezifischen regulatorischen Standards entsprachen.
Tatsächlich war es eine großartige Investition für uns, da es der Moment ernsthafter Verbesserungen und vieler fruchtbarer Diskussionen über aktuelle und zukünftige Prozesse in unserem Unternehmen war.
Einer der größten Herausforderungen bestand darin, sicherzustellen, dass jedes Teammitglied diese Standards verstand und wie sie auf seine tägliche Arbeit angewendet wurden. Regulatorische Leitlinien können komplex sein, und sie in praktische Maßnahmen umzusetzen war für uns alle eine Lernkurve.
Wir wussten, dass der Zertifizierungsprozess nur dann erfolgreich sein würde, wenn jedes Teammitglied engagiert war und die gleiche Vorstellung hatte, daher haben wir Schulungen und offene Kommunikation über die Gründe für all dies priorisiert.
 Die ISO-Zertifizierungen von Scythe Studio
Die ISO-Zertifizierungen von Scythe Studio
Mit einem gut durchdachten Plan und einem kollaborativen Teamgeist gingen wir Schritt für Schritt voran. Im Laufe der Zeit brachte uns dieser Prozess nicht nur der Zertifizierung näher, sondern stärkte tatsächlich unsere internen Systeme.
Heute sehen wir die Vorteile unserer harten Arbeit. Die Zertifizierung hat nicht nur unseren Fokus auf Qualität in der Entwicklung von Medizinprodukte-Software verbessert, sondern auch unsere Fähigkeit, Kundenanforderungen besser zu verstehen, verstärkt.
Sie können unsere Anerkennungen auf unserer Zertifikationsseite einsehen.
Kommen wir zur Sache: Es ist eine Herausforderung, Top-Qt-QML-Entwickler zu finden. Helfen Sie sich selbst und starten Sie die Zusammenarbeit mit Scythe Studio – echten Experten im Qt C++ Framework.
Entdecken Sie unsere Fähigkeiten!
Ich werde nicht lügen: Viele der Projekte, die wir bei Scythe Studio durchführen, sind mit der Medizingerätebranche verbunden. Wir haben […]
Handelssoftware bezeichnet digitale Plattformen und Systeme, die es Investoren und Finanzinstitutionen ermöglichen, Finanzanlagen online zu kaufen, zu verkaufen und zu […]
Verifikation und Validierung (V&V) sind zwei Grundpfeiler, die sicherstellen, dass ein Medizinprodukt sicher, wirksam und konform ist, bevor es überhaupt […]